Les traitements du myélome multiple1-3
Le traitement du myélome multiple est basé sur une association de plusieurs médicaments qui regroupe des agents de chimiothérapie, des thérapies ciblées, des immunothérapies et des corticoïdes. Ces différentes molécules peuvent, selon les cas, être administrées par voie orale, sous-cutanée (SC) ou intraveineuse (IV). Les médicaments employés, les doses prescrites, ainsi que le rythme des cures sont adaptés en fonction des spécificités de chaque patient.
La chimiothérapie
En raison de l’arrivée des thérapies ciblées et immunotherapies souvent mieux tolérées, la chimiothérapie est moins utilisée qu’autrefois. Cependant, elle reste précieuse en cas de contre-indication ou de mauvaise tolérance à un traitement et reste indispensable dans le cadre de l’autogreffe1.
Elle comporte le plus souvent un agent alkylant qui inhibe la synthèse et l’expression de l’ADN des cellules myélomateuses pour les détruire. Plus rarement, d’autres molécules de chimiothérapie peuvent être utilisées.
Les traitements ciblés
Ces médicaments sont conçus pour bloquer la croissance ou la propagation des cellules cancéreuses. Ils interfèrent avec des mécanismes qui sont à l’origine de leur développement, de leur dissémination ou en entraînant des altérations moléculaires. Cette action dite « ciblée » permet d’agir plus spécifiquement sur les cellules tumorales et ainsi de limiter les dommages induits aux cellules normales.
Les immunothérapies
Administrés par voie IV ou SC, les traitements d'immunothérapie agissent en stimulant les défenses immunitaires naturelles du patient pour lutter contre les cellules cancéreuses.
Les corticoïdes
Ils sont utilisés pour leur action anti-inflammatoire qui permet de réduire la croissance des plasmocytes anormaux et le taux d'immunoglobuline monoclonale.
Le schéma thérapeutique avec autogreffe de cellules souches hématopoïétiques1,2,4
Pour les patients éligibles, le protocole de référence allie traitements médicamenteux et autogreffe de cellules souches hématopoïetiques (en général pour les patients âgés de moins de 65 ans)1. Il se déroule en quatre phases.
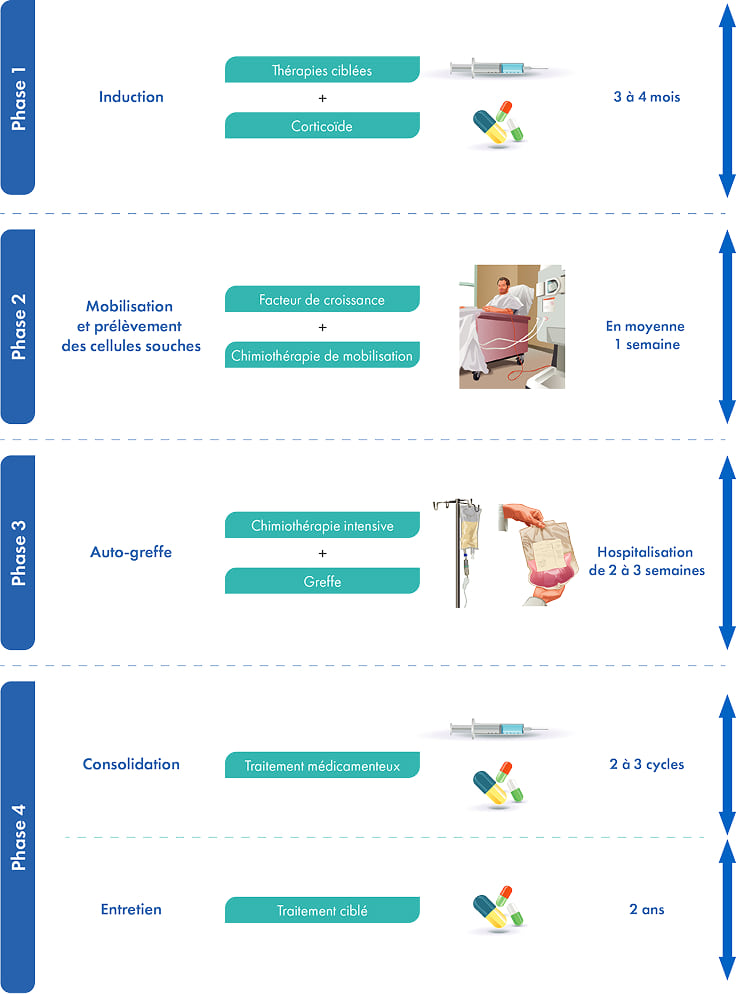
Phase 1
La phase d’induction combine des thérapies ciblées et un corticoïde. L’objectif est de réduire le nombre de cellules tumorales présentes dans la moelle osseuse. Elle dure environ 3 à 4 mois.
Phase 2
Cette étape dure quelques jours. Elle a pour objectif de prélever les cellules souches hématopoïétiques, directement dans le sang. Elles serviront à reconstituer la moelle osseuse qui aura été détruite lors de la phase de traitement intensif. Une étape de stimulation de la moelle osseuse à l'aide de facteurs de croissance débute quelques jours avant le prélèvement des cellules souches hématopoïétiques par cytaphérèse. Le greffon ainsi obtenu est ensuite congelé afin d’être conservé en attendant la greffe.
Phase 3
L’autogreffe commence par une chimiothérapie intensive pour détruire toutes les cellules cancéreuses. Le traitement va également détruire les autres cellules de la moelle osseuse. C'est-ce que l'on appelle l'aplasie médullaire. Le greffon prélevé à la phase 2 est réinjecté par voie intraveineuse. Les cellules souches hématopoïétiques retrouvent alors leur place dans la moelle osseuse. Le patient est ensuite maintenu en chambre protégée pendant 2 à 3 semaines afin d’éviter tout risque d’infection en attendant la sortie d’aplasie.
Phase 4
Une période de récupération d’environ 2 mois suit l’autogreffe et précède les dernières phases du protocole. Un traitement médicamenteux sera ensuite administré, la plupart du temps pendant 2 à 3 cycles : c’est la phase de consolidation. Il peut être prolongé par un traitement d’entretien. Il s'agit d'administrer de faibles doses de médicaments pendant une longue période (jusqu’à 2 ans). L’objectif est de maintenir la maladie en rémission et de prévenir la rechute.
SC : Sous-Cutanée
IV : Intraveineuse
Références
- Fondation pour la recherche sur le cancer. Les myélomes multiples. 2024.
- INCa. Comprendre le myélome multiple. 2015. https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Comprendre-le-myelome-multiple
- InfoCancer. Myélome multiple. L’immunothérapie. https://www.arcagy.org/infocancer/localisations/hemopathies-malignes-cancers-du-sang/myelome-multiple/avenir/l-immunotherapie.html/ Consulté le 14 mai 2025.
- INCa. Les traitements médicamenteux. https://www.e-cancer.fr/Patients-et-proches/Les-cancers/Comprendre-le-myelome-multiple/Prise-en-charge/Les-traitements-medicamenteux Consulté le 14 mai 2025.
Bienvenue
sur le site AmgenPro
Une ressource dédiée pour vous accompagner dans votre pratique.
Veuillez consulter les informations légales et les conditions générales d'utilisation avant de continuer.




