Les Biosimilaires en bref
Qu’est-ce qu’un biosimilaire1 ?
Un biosimilaire est un médicament biologique, de même composition quantitative et qualitative en substance active, et de même forme pharmaceutique que le biomédicament de référence.
Quelles sont les caractéristiques d’un biosimilaire2 ?



Quelles sont les grandes étapes de développement d’un biosimilaire2 ?
Le développement d’un médicament biosmilaire est un processus comparatif exhaustif se déroulant en plusieurs étapes et dont la finalité est de démontrer la biosimilarité avec le médicament biologique de référence.
-
1. Études comparatives de la qualité
Ces études de comparaison portent sur la structure et la fonction biologique de la molécule
- Analytiques : propriétés physiques + chimiques
- Fonctionnelles : activité biologique/pharmacologique
-
2. Études non cliniques comparatives
Cette étape consiste en l’examen de la liaison de la molécule à sa cible physiologique, de son activation (ou inhibition), et des effets physiologiques immédiats attendus dans les cellules.
- Pharmacodynamique
- Toxicologie
-
3. Études cliniques comparatives
Enfin, les études cliniques comparatives permettront la confirmation de la biosimilarité et réponse à toute question encore en suspens à l’issue des études analytiques ou fonctionnelles précédentes
- Pharmacocinétique / pharmacodynamique
- Efficacité + sécurité + immunogénicité
En moyenne, environ 9 années sont nécessaires pour démontrer la biosimilarité3.
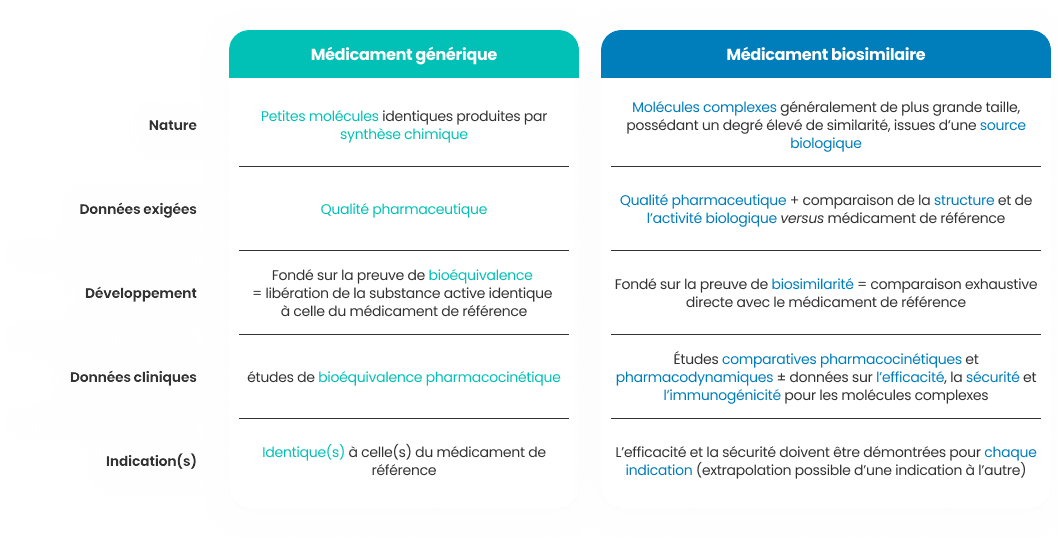
Et la différence avec les médicaments génériques2 ?
Les biosimilaires présentent une variabilité inhérente à leur nature et à leurs procédés de fabrication2,4.
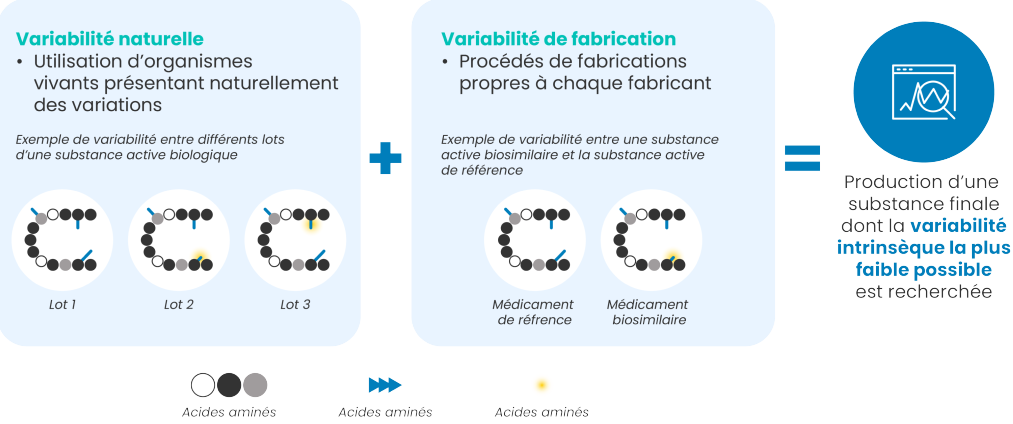
L’objectif recherché est d’obtenir la production d’une substance finale dont la variabilité intrinsèque est la plus faible possible.
De nombreux contrôles permettent de s’assurer que ces variabilités se situent dans une fourchette acceptable pour garantir in fine une activité thérapeutique et un profil de tolérance identiques à chaque utilisation.
Références
- VIDAL. Infos pratiques génériques et médicaments biosimilaires : médicaments biosimilaires. 2022.
- EMA. Les médicaments biosimilaires dans l’UE. Guide d’information destiné aux professionnels de la santé. 2019.
- Simon Kutcher & partners. Payers’ price & market access policies supporting a sustainable biosimilar medicines market. [En ligne] https://www.medicinesforeurope.com/wp-content/uploads/2016/09/Simon-Kucher-2016-Policy-requirements-for-a-sustainable-biosimilar-market-FINAL-report_for-publication2.pdf. Consulté le 17/01/2023.
- ANSM. État des lieux sur les médicaments biosimilaires. 2022.
Ces contenus pourront vous plaire

Livret - Comprendre mon traitement
Vous trouverez dans ce livret des informations sur ce qu’est un anti-TNF alpha, les modalités...
Bienvenue
sur le site AmgenPro
Une ressource dédiée pour vous accompagner dans votre pratique.
Veuillez consulter les informations légales et les conditions générales d'utilisation avant de continuer.

